미코 주가정보 정리(미코바이오메드 진단키트)
미코 주가 종목이슈


<1/30 자회사 미코바이오메드, 코스닥 상장 위한 기술성 평가 통과 소식>
미코의 자회사 미코바이오메드가 한국거래소가 지정한 평가기관인 나이스디앤비와 이크레더블에서 모두 A등급을 받았으며, 연내 코스닥시장 상장을목표로 하고 있는 것으로 전해졌습니다. 기술특례상장을 추진하는 기업은 전문평가기관 두 곳 중 한 곳은 A등급 이상, 다른 한 곳은 BBB등급 이상을 받아야 특례상장을 신청 할 수 있는 것으로 알려져 있습니다.
2009년 설립한 미코바이오메드는 박테리아, 바이러스 등의 병원체로부터 유전자를 신속 정확하게 추출, 증폭, 진단하는 랩온어칩 기반 분자진단 장비와 키트를 개발해 사업화했으며, 미코바이오메드가 개발한 진단 장비 및 키트를 이용하면 최근 문제가 된 코로나19 같은 치사율이 높은 고위험성 바이러스를 현장에서 신속 정확하게 측정할 수 있어 무선 통신으로 질병을 관리·통제하는데 기여할 것으로 기대되고 있습니다. 미코바이오메드의 진단키트는 공항, 항만, 터미널, 병원 등에서 한 시간 안에 확진 판정을 내릴 수 있다는게 회사측 설명입니다.
열이 나는 경우 질병 원인균인 인플루엔자, 지카, 뎅기, 말라리아, 황열 등 14종류를 동시 다중 진단합니다. 또한 아프리카돼지열병 등 동물 관련 바이러스와 식중독 등 음식물 관련 바이러스도 현장 진단할 수 있습니다.
미코바이오메드는 빠르고 정확하면서 저렴하게 현장에서 진단한 결과를 의사나 질병관리본부 등에 스마트폰으로 빠르게 전달하는 체외 진단 기술력을 보유했습니다. 선진국 17개국에 특허를 확보하고 식중독과 고위험성 질병 진단을 사업화했습니다.
미코바이오메드는 연내 코스닥시장 상장을 목표하고 있습니다.
<2/27 미코바이오메드, 코로나19 진단시스템 수출 시작>


미코 자회사 미코바이오메드는 홍콩에 자사의 장비와 진단키트 판매를 개시했다고 밝혔습니다. 홍콩 내 협력업체인 DNA WeCheck에 장비 진단시약을 문자상표부착방식(OEM)으로 수출하게 됩니다.
홍콩이외에도 미코바이오메드는 코로나19를 현장에서 빠르게 진단하는 제품을 필요로 하는 WHO(세계보건기구), 미국, 일본 등 지역의 판매 승인도 추진 하고 있습니다.
미코바이오메드의 진단 키트는 기존 검사 시간인 6시간보다 훨씬 빠른 1시간 내에 진단이 가능합니다. 또 기존 검사장비와 달리 4kg의 소형화된 RT PCR장비로 이동식 검사소와 모바일 차량, 공항, 항만 등에서도 사용할 수 있는 장점이 있고 항원진단키트보다 정확도가 우수한 것으로 알려졌습니다.
<3/6 미코바이오메드 코로나19 신속진단장비 미국수출 추진,긴급사용 승인 기대>
미코바이오메드는 코로나19 RT-PCR 검사에 필요한 소형 장비인 VERI-Q PCR 316 과 VERI-Q Prep M16, 이 장비에 쓰는 진단시약을 개발했습니다. 지난 1월 29일 질병관리본부에 긴급사용승인 신청을 했습니다.
미코바이오메드가 개발한 제품은 무게가 4㎏에 불과해 휴대가 간편합니다. 현재 검사기관에서 사용하는 외국 기업 제품은 무게가 30㎏ 이상인 것을 고려하면 무게를 획기적으로 줄였으며 핵산 추출 방식도 개선해 기존 제품보다 소요 시간도 3분의 1로 줄였습니다. 국내에서는 말라리아, 결핵, 댕기열 진단시약과 함께 사용할 수 있게 허가받았습니다. 유럽에서는 21개 질환을 대상으로 CE 인증을 받았습니다.
<3/10 미코바이오메드 WHO관련 비영리기구의 인증 명단 등재>
미코바이오메드의 진단키트가 세계보건기구(WHO)와 협조하는 스위스 소재 비영리기구인 '파인드(FIND)'의 인증 명단에 올랐습니다. FIND는 150개 이상의 파트너사와 협력해 각종 질병에 대한 진단기구를 개발 및 평가, 제품화하고 있습니다. 통상적으로 FIND에서 인정하면 WHO, 빌 앤 멜린다 게이츠 재단의 지원으로 저개발국가 등 각국에 진단기 지원이 가능하게 됩니다.
<3/11 미코바이오메드 코로나19 진단키트 유럽인증 획득>
미코바이오메드는 코로나19의 감염여부를 확진할 수 있는 분자진단키트가 지난 7일 유럽인증을 획득했습니다. 유럽인증을 획득한 제품은 미코바이오메드가 자체 개발한 코로나19 검사 진단키트(PCR Kit nCoV-QS)와 유전자 추출키트(PREP Kit 16TU-CV19)입니다.
또한 자회사 미코바이오메드가 WHO 협력기구인 FIND에 코로나19 감염 분자진단키트의 인증을 신청해 조만간 승인을 기대하고 있으며, 미국 FDA에도 사용 신청을 준비하고 있습니다. 미코바이오메드는 무게와 크기 및 진단 속도에 한계를 가진 기존 외산 장비와 비교해 가볍고 빠른 진단 속도로 한국 식품의약품안전처에 의료기기로 허가를 이미 받았습니다.
해당 제품은 혁신적인 기술을 도입하여 POCT(현장진단)화한 미코바이오메드의 장비가 기존 진단 장비의 검사 시간인 6시간 대비 훨씬빠른 1시간내에 진단이 가능하고, 기존 검사장비와 달리 4kg의 소형화된 RT PCR장비로 이동식 검사소와 모바일 차량, 공항, 항만 등에서도 사용할 수 있다는 장점이 있습니다. 이에 맞는 코로나19 진단키트를 개발하였기에 빠른 인증 획득이 가능했습니다.
미코바이오메드는 이번 유럽 인증 획득을 계기로 이탈리아를 비롯한 유럽 전역에 판매를 개시하고, 유럽 인증을 인정해주는 많은 국가에도 수출을 추진한다는 계획입니다. 한편 미코바이오메드는 국내 질병관리본부에도 지난 1월 해당 제품의 긴급 사용 허가를 신청한 상태로 당국의 임상 성능 평가를 기다리고 있습니다.
<3/18 미코바이오메드, 방글라데시에 진단시스템 공급>
미코의 자회사 미코바이오메드는 3/18일 방글라데시 정부에 세계보건기구(WHO) 자금 지원으로 코로나19 진단시스템을 공급한다고 밝혔습니다. 한편, 방글라데시는 자국내 코로나19 확산을 막기 위해 WHO의 구호자금을 활용해 미코바이오메드 진단 제품으로 검사를 진행하기로 했습니다. 이미 긴급 검사센터에 미코바이오메드의 기기를 설치했으며 추가도입을 확대할 것으로 알려졌습니다.
지난 1월 국내에 코로나19 진단키트에 대한 긴급사용 허가 신청을 한 미코바이오메드는 국내 허가 승인 이전에도 중국 및 중동과 같이코로나19 확산 국가에서 임상 실험을 진행하여 자사의 제품에 대한 우수성을 입증했습니다.
<3/24 미코바이오메드, 코로나19진단키트 세네갈 수출 및 미국 CDC 임상진행>
미코의 자회사 미코바이오메드는 세네갈에 1차로 분자 진단 장비 30set(유전자 추출 PREP장비와 유전자 증폭 검출 PCR장비)와 진단 시약 2만 테스트 규모의 코로나19 진단키트를 수출한다고 24일 밝혔습니다. 얼마 전 세네갈 파스퇴르 연구소에서 임상 실험을 통해 유효한 성능 평가 결과를 얻어 공급이 성사되었습니다.
이번 1차 물량 이후 세네갈 파스퇴르 연구소 산하 20개 보건소에 확대 보급되어 추가적인 공급이 이루어질 예정이며, 세네갈에 이어 아프리카 여러 나라에서도 공급 요청이 이어질 전망입니다.
한편, 미코바이오메드는 미국 CDC(질병통제예방센터)에 빠르게 200테스트분의 진단키트를 보낼 예정입니다. 이는 CDC에 임상테스트 진행을 요청하고 임상 결과 보고서를 FDA(미국 식품의약품)에 제출하여 긴급 사용 허가를 조속히 받고자 하는 것으로 보입니다. 미국 CDC는 작년 하반기에 말라리아 임상 실험을 진행한 후 지속적인 협력을 위해 미코바이오메드의 진단 장비 1set를 보유 중이었습니다.
미국의 경우, 지난 21일(현지시간)에 의료기기 기업인 세페이드(Cephheid)사의 POCT진단 장비인 진엑스퍼트의 코로나19 진단키트에 대해 FDA가 긴급 사용 허가를 승인했습니다. 세페이드의 진단장비가 미코바이오메드의 PCR진단장비(Veri-Q PCR316)와 동일한 POCT 진단장비로 알려졌습니다. 미코바이오메드는 국내뿐 아니라 WHO 및 FDA에도 긴급 사용 허가 신청을 한 상태입니다.
우리나라에서도 미코바이오메드의 장비와 시약을 사용한다면 미국과 같이 1시간이내로 진단 시간을 대폭 줄일 뿐만 아니라, 4kg대의 소형화 장비로 검사 장소의 한계를 극복하여 선별진료소 및 공항 등 현장에서 신속하게 진단할 수 있으며 이런 선진적인 진단 시스템을 구축해 효율적인 방역 시스템으로 이어질 수있을 것으로 보고 있습니다.
미코바이오메드는 유럽인증을 획득한 후 이탈리아,폴란드,헝가리,루마니아 등 유럽 각 국 및 중동을 포함한 아시아 각 국에서 진단시스템 공급 요청이 쇄도하고 있어 공급 협상을 진행하고 있는 것으로 알려졌습니다.
<3/25 미코바이오메드의 진단키트 FDA 긴급사용승인 기대감>
미코 자회사인 미코바이오메드의 진단키트가 미국 식품의약국(FDA) 긴급 사용승인이 예상보다 일찍 승인될 수 있을거라는 전망입니다.
도널드 트럼프 미국 대통령의 긴급 요청으로 지난 24일 한미 정상 간 통화가 이뤄졌습니다. 먼저 트럼프 대통령이 "한국이 미국의 코로나19 대처를 위해 의료 장비를 지원해 줄 수 있느냐"고 물었고, 이에 문재인 대통령은 "국내 여유분이 있으면 최대한 지원하겠다" 고 답했습니다. 이에 대해 문재인 대통령이 "미 FDA 승인 절차가 필요할 수 있다"고 하자, 트럼프 대통령은 "오늘 중 승인되도록 즉각 조치하겠다"며 적극적인 태도를 보였다고 청화대 측은 전했습니다.
미국이 요청한 장비는 코로나19 검체 채취와 검사 장비를 포함한 진단 키트 세트인 것으로 알려졌습니다.
<3/27 미코의 자회사 미코바이오메드가 식약처로부터 진단키트 수출 허가 승인>
미코바이오메드는 식품의약품안전처로부터 PCR분자진단 장비에 사용하는 코로나19 진단 키트에 대한 수출 허가를 받았다고 밝혔습니다.
미코바이오메드는 유전자 증폭(PCR) 분자 진단 장비를 방글라데시와 세네갈 등에 수출하고 있으며, 브라질로부터는 이동 차량에 미코바이오메드의 PCR장비 10SET를 설치해 모바일랩(Mobile Lab)으로 검사실을 운영한다고 밝히고, 5만테스트 물량의 시약을 주문받았다고 전해졌습니다. 또한 이동 차량 외에 검사소에 공급할 물량도 협의 중이라고 밝혔습니다.기존 PCR 분자진단 장비에 대해 의료기기 허가와 수출 허가를 받은 데 이어 진단키트가 추가로 수출 허가를 획득한 만큼 미코바이오메드가 해외 공급을 확대될 것으로 전망되고 있습니다.
한편 미코바이오메드는 지난 7일 유럽 의료기기 인증(CE인증)을 획득했고 미국 식품의약국(FDA)에도 긴급사용승인을 신청해 결과를 기다리고 있습니다. 보건복지부는 코로나19 진단키트 수출지원 방안으로 검체 보유 의료기관과 진단 기업 간 연결(매칭) 서비스를 제공하기로 했습니다. 정부차원의 체계적 매칭을 통해 보다 수월한 제품 성능 평가가 이루어지고 이를 기반으로 수출허가를 신속히 받을 수 있도록 할 계획입니다.
미코 기업개요

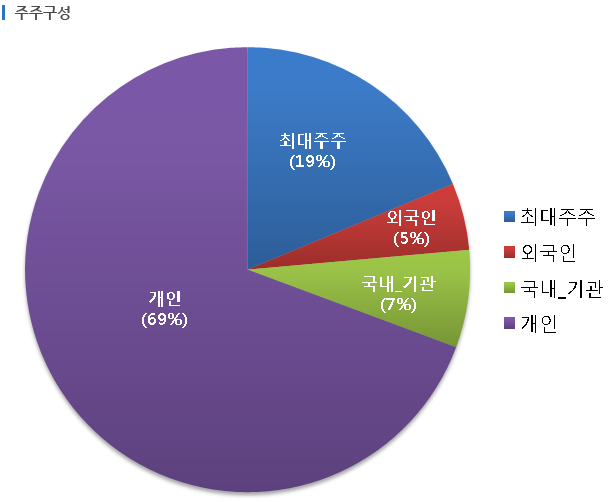
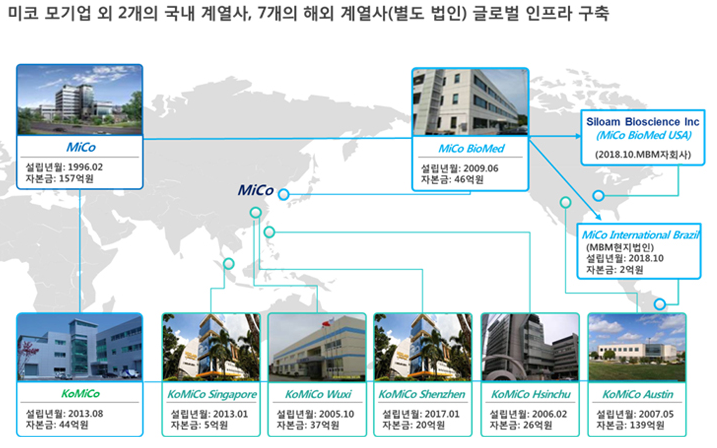
미코는 1999년 7월 16일에 설립되었으며, 2002년 1월 15일자로 코스닥시장에 상장했습니다. 종속회사 8개사를 포함하여 주요 사업으로 반도체 및 엘씨디 장비를 구성하는 부품을 제작하는 부품사업부문과 반도체 및 엘씨디 장비를 구성하는 부품의 세정과 코팅을 영위하는 세정사업부문이 있습니다. 주요 제품으로는 Heater, ESC 및 세라믹 부품 등이 있습니다. 반도체/태양광/디스플레이 산업부문의 정밀세정 및 특수 코팅 사업을 영위하고 있는 코스닥 상장사 코미코를 종속회사로 보유하고 있습니다. 미코의 매출은 세정사업 약 73%, 부품사업 약 27%로 구성되어 있습니다.
미코 실적
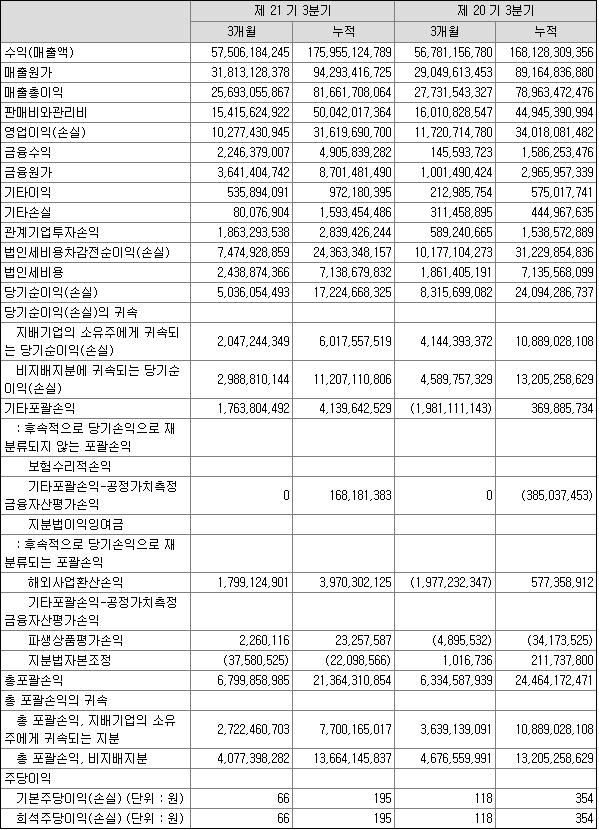
2019년 9월 전년동기 대비 연결기준 매출액은 4.7% 증가, 영업이익은 7% 감소, 당기순이익은 44.7% 감소했습니다. 매출액이 증가하였지만, 매출원가, 판매비와관리비의 증가로 영업이익이 감소했습니다. 반도체 Chip Maker들의 공정이 미세화 되는 추세로 증착,식각 공정에 대한 수요가 늘어 동사의 주력제품 증착 장비용 고기능성 세라믹 히터와 식각장비용 고기능성 세라믹 ESC 등의 수요도 늘 것으로 전망되고 있습니다.
진단키트 관련주 대장주 테마주 13종목 총정리
진단키트 관련주 대장주 테마주 코로나19가 전 세계적으로 확산되면서 코로나19 진단키트 수요가 폭발하며 국내 진단시약 개발 업체에 대한 해외 주요 보건당국의 문의가 쏟아지고 있습니다. 이에 진단키트 관련..
no8888.tistory.com
랩지노믹스 주가 정보(검사센터)
랩지노믹스 진단키트 해외수출 진행상황 <코로나19 진단키트 수출허가 취득 및 중동지역 판매> 분자진단 헬스케어 전문기업인 랩지노믹스는 3월 3일 식품의약품안전처로부터 코로나19 진단키트의 수출 품목허가..
no8888.tistory.com
수젠텍 어떤회사인가?(신속진단키트 개발)
1월 29일 수젠텍 중국 헬스케어 업체와 '코로나19' 진단키트 개발 위한 MOU 체결하다. 바이오 진단 전문 기업인 수젠텍이 국내 최초이자 국내에서 유일하게 중국 10대 헬스케어 업체인 휴먼웰 헬스케어 그룹과..
no8888.tistory.com
씨젠 파헤치기(진단키트 관련주)
씨젠 코로나19 진단키트 주문 요청 쇄도 소식에 상한가 코로나19가 전 세계적으로 퍼지면서 코로나19 진단키트 수요가 폭발하자 코로나19 진단키트 관련주 종목들의 주가가 급등했습니다. 코스닥 상장주인 씨젠..
no8888.tistory.com
해당글은 종목추천이 아니며 사실과 다른내용이 포함되어 있을수 있습니다. 투자판단의 최종책임은 본인에게 있으니 이점에 유의하시고 참고만 하시길 바랍니다.
조금이나마 도움이 되셨다면 로그인 필요없는 ♡공감 클릭 부탁드립니다.














